二次電池(充電することで繰り返し使える電池)の1つである鉛バッテリー。自動車やバイクにはなくてはならないものです。
この鉛バッテリー、水素ガスが出るんじゃないの?だとしたら繰り返し使えないんじゃないの?という誤った疑問から、どのような化学反応で電気を充電、放電しているのかを調べてみました。
鉛バッテリーの材料
まず鉛バッテリーに使われている材料です。
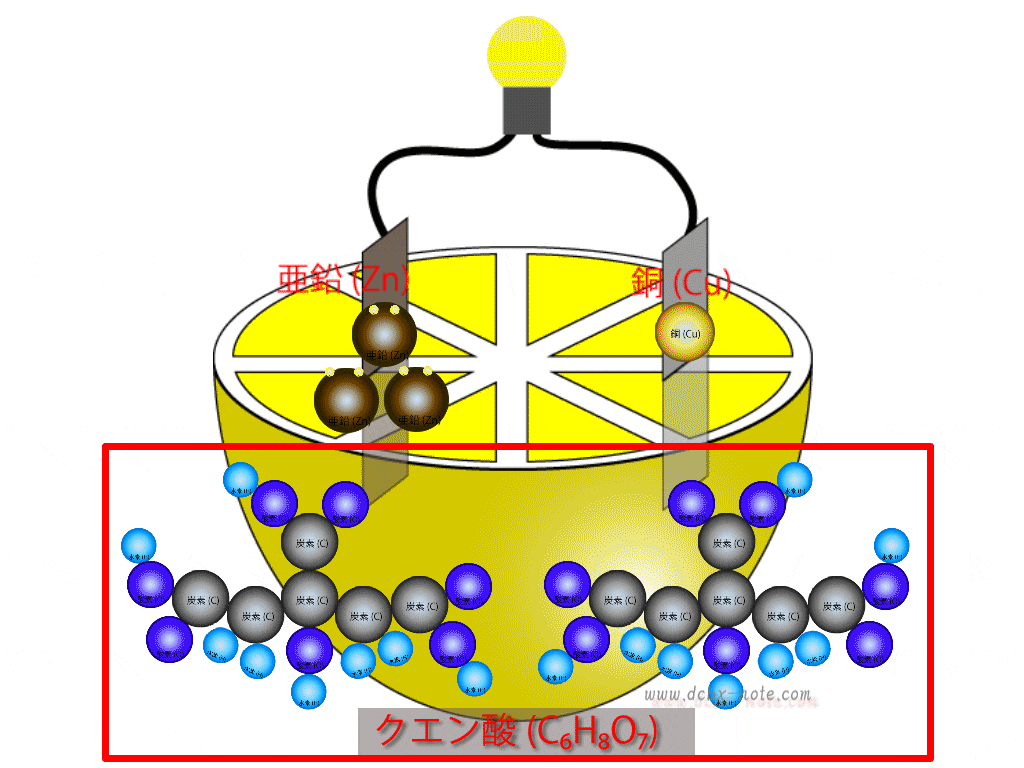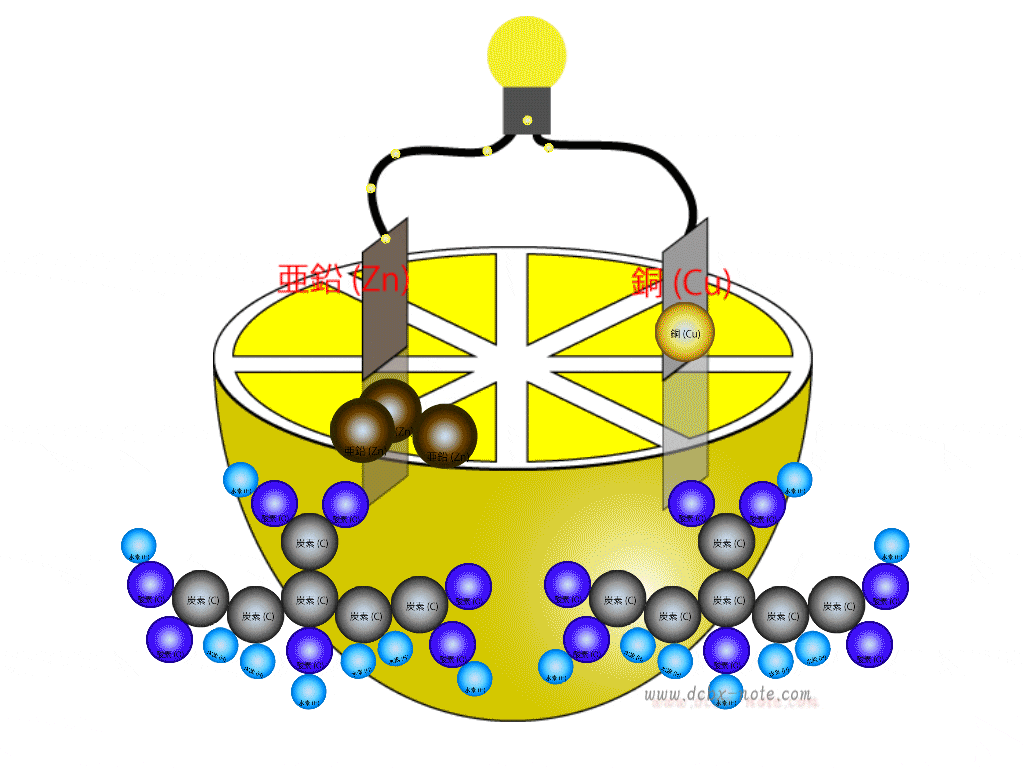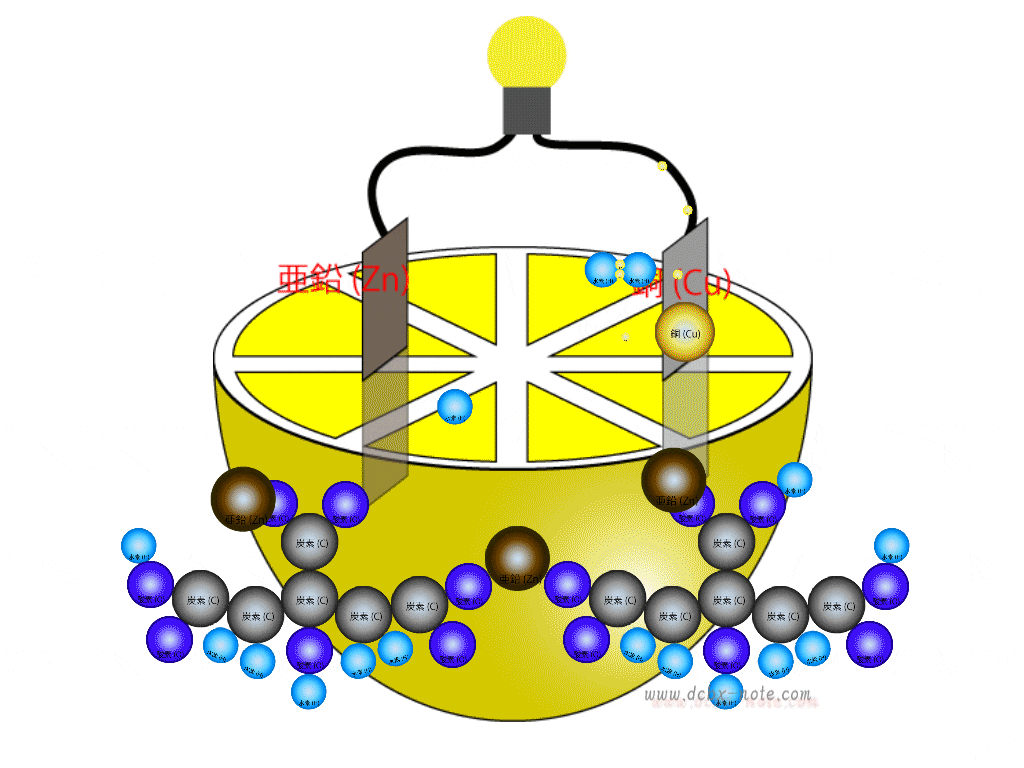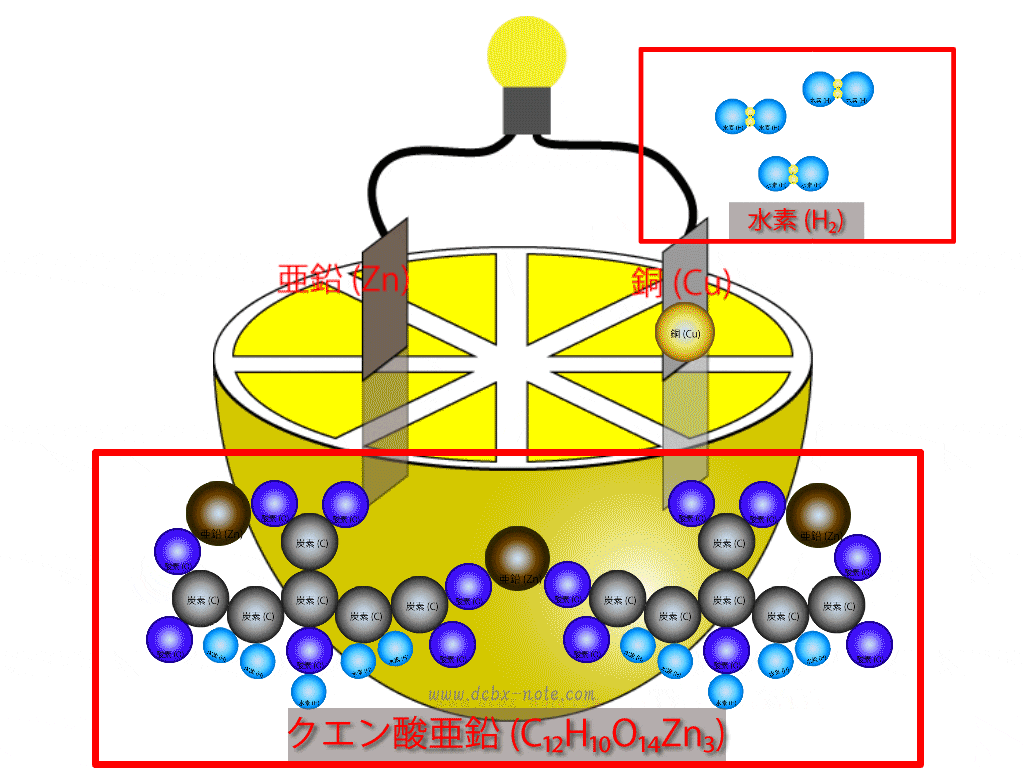
希硫酸(H2SO4)液
鉛(Pb)の板…陰極(マイナス)
二酸化鉛の板…陽極(プラス)
その他…容器や電極など
バッテリー内の化学反応(放電時)
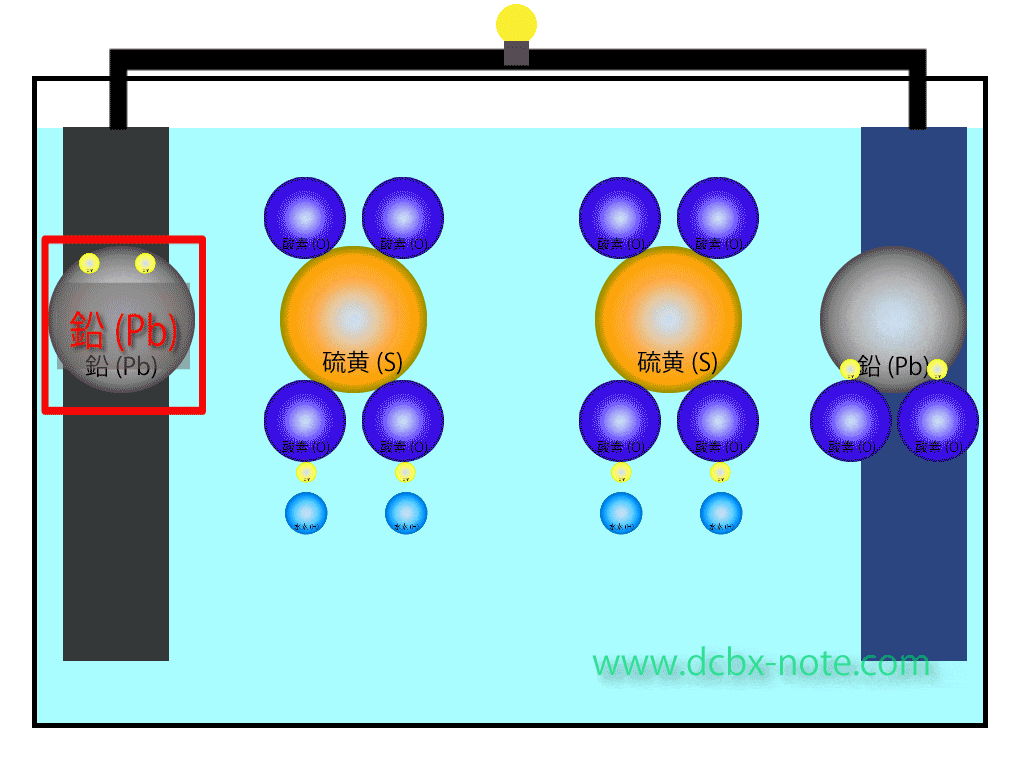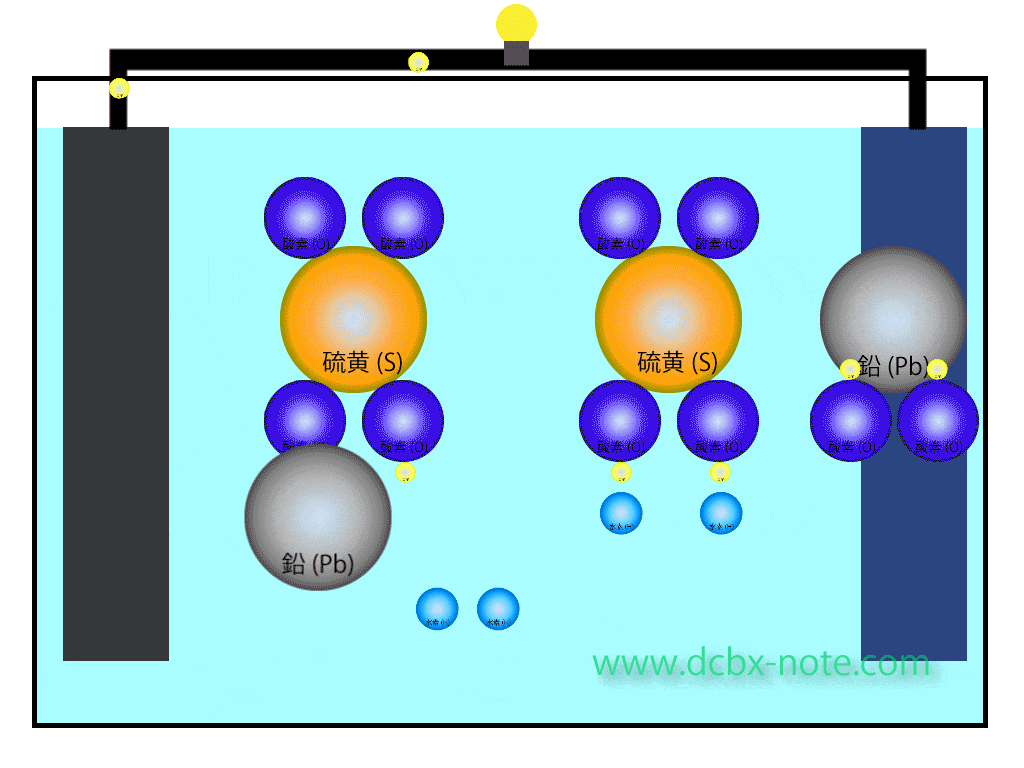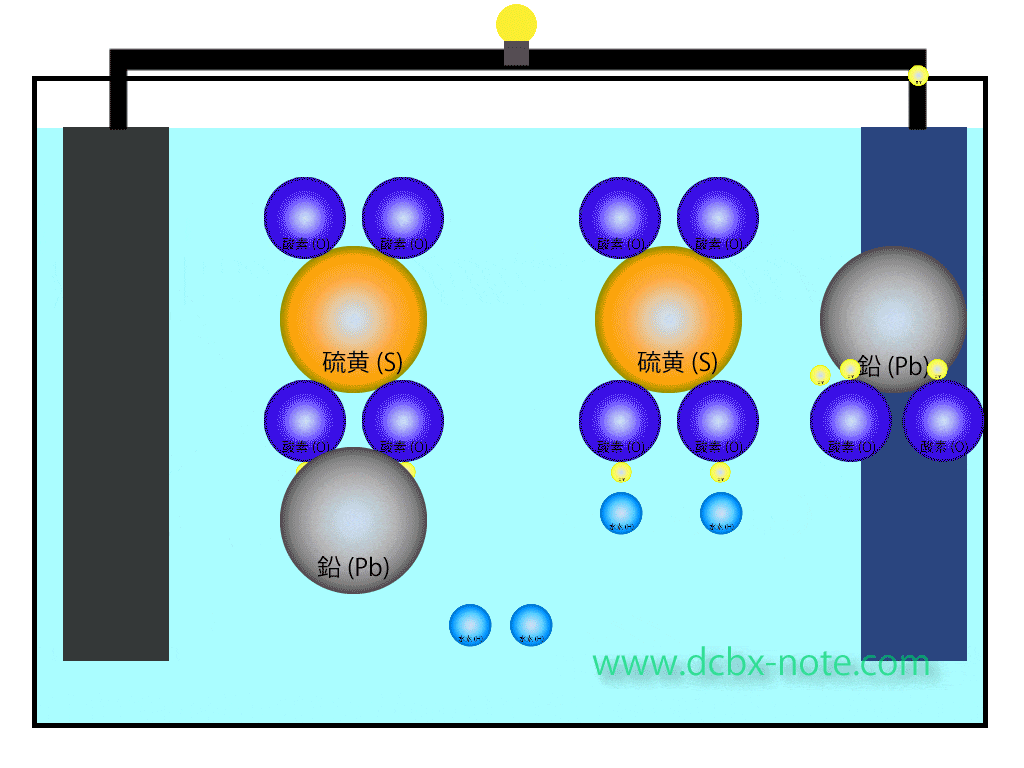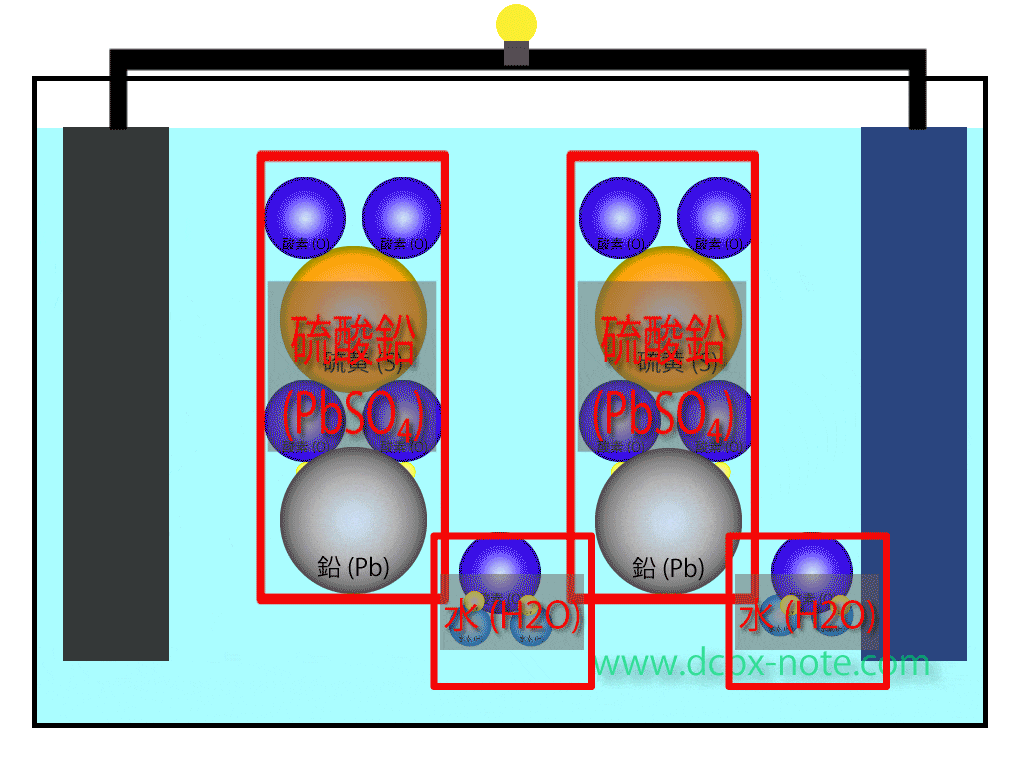
陰極(マイナス)側
鉛(Pb)は希硫酸(H2SO4)に触れると電子を放出し硫酸鉛(PbSO4)に変化します。
希硫酸からは水素原子(H)が2個離れますされます。
この水素原子は電子を持っていませんので、プラスイオン状態です。
鉛から放出された電子は回路を伝わって陽極側に移動します。
陽極(プラス)側
二酸化鉛(PbO2)の中の鉛も希硫酸(H2SO4)と反応し、酸素原子(O)2個を離して硫酸鉛(PbSO4)に変化します。
このとき陽極側でも、希硫酸からは水素原子(H)が2個離れますされます。
この水素原子は電子を持っていませんので、プラスイオン状態です。
希硫酸液の中には陰極(マイナス)側で離された水素原子(イオン状態)2個、陽極(プラス)側で離された水素原子(イオン状態)2個で計4個の水素原子と、陽極(プラス)側で二酸化鉛から離された酸素原子2個が余っている状態です。
ここに陰極(マイナス)から移動して来た電子が合わさり、水(H2O)分子が2個できます。
鉛バッテリー放電のイメージ
放電時のイメージをアニメーションで表してみます。
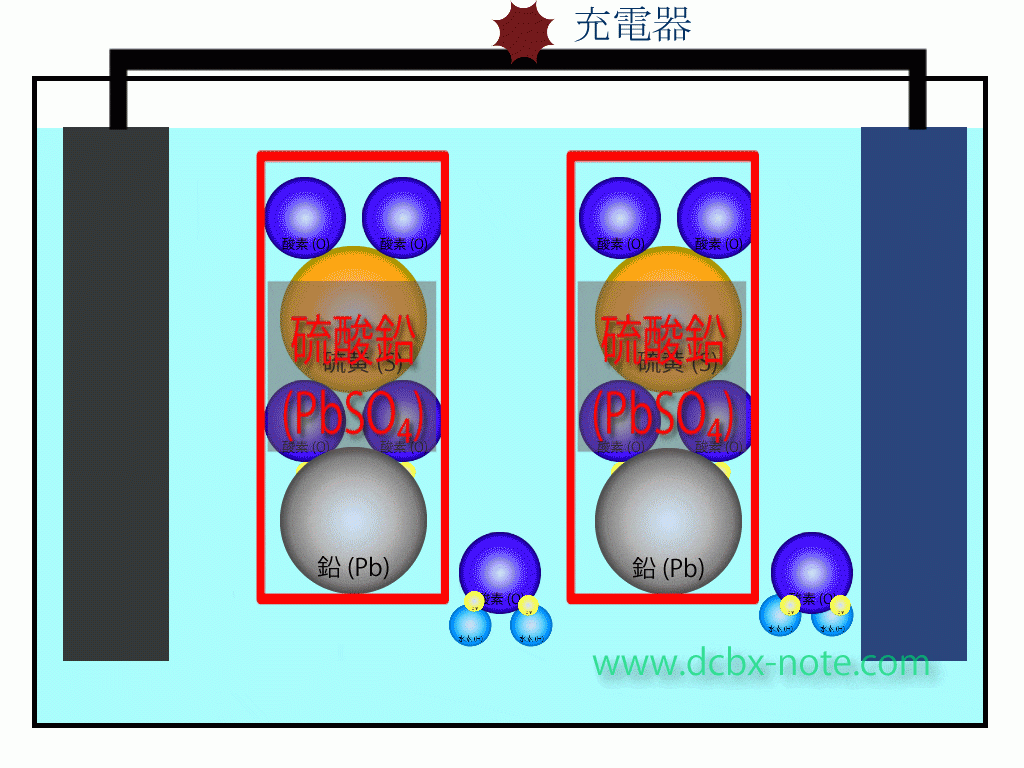
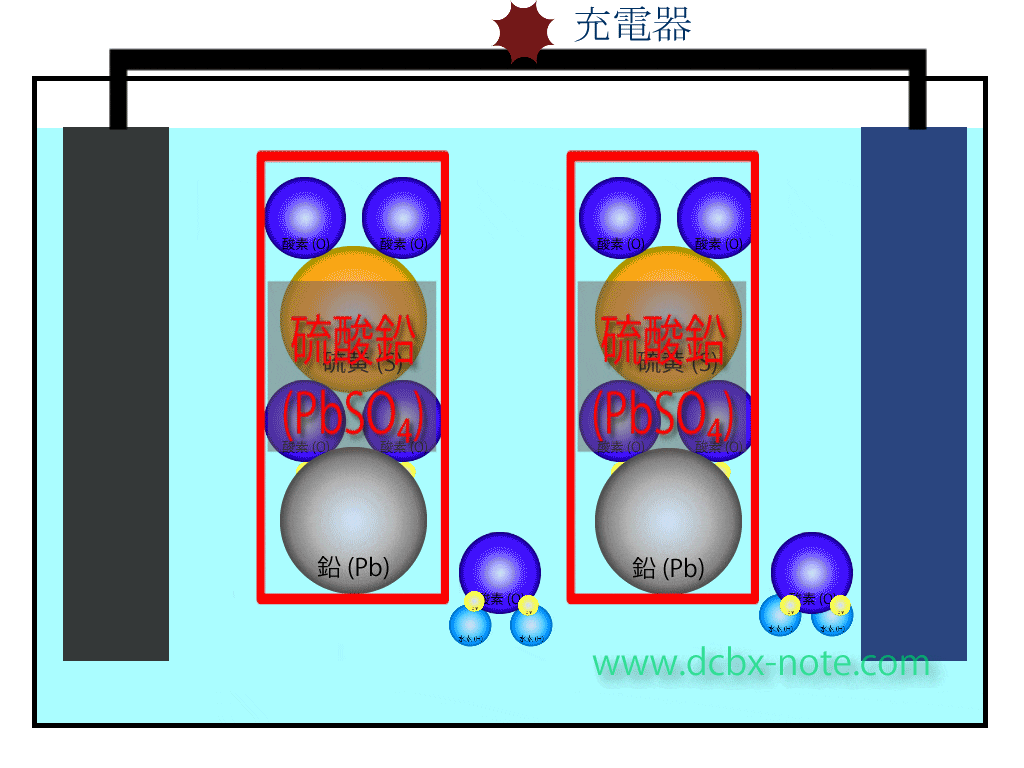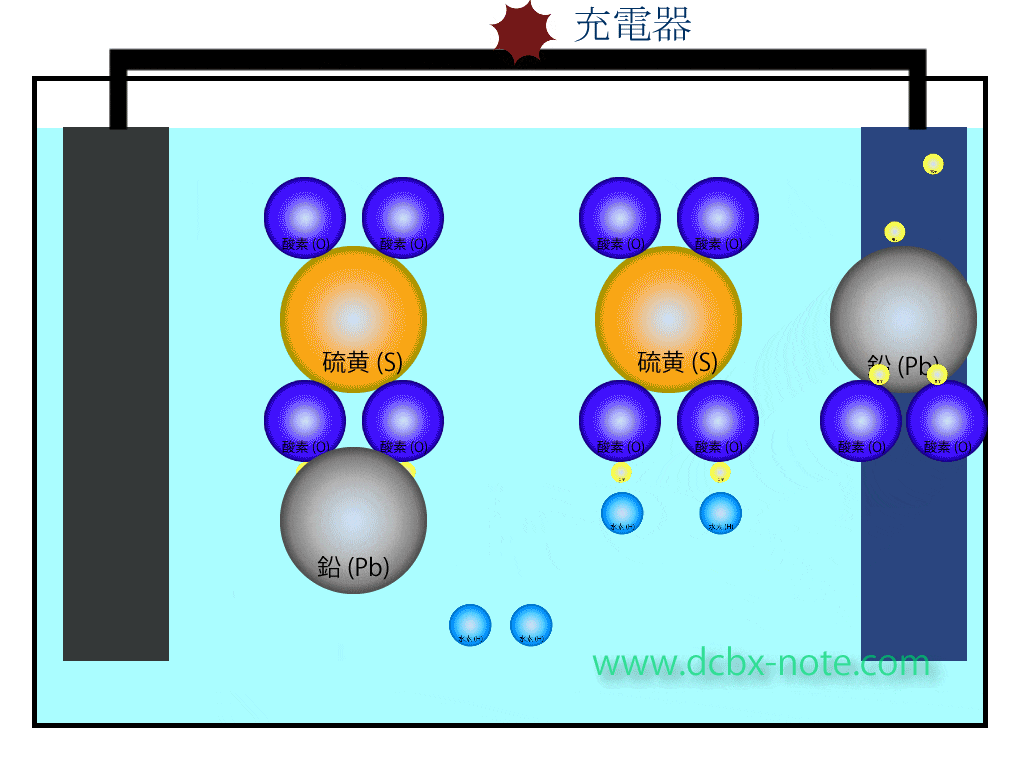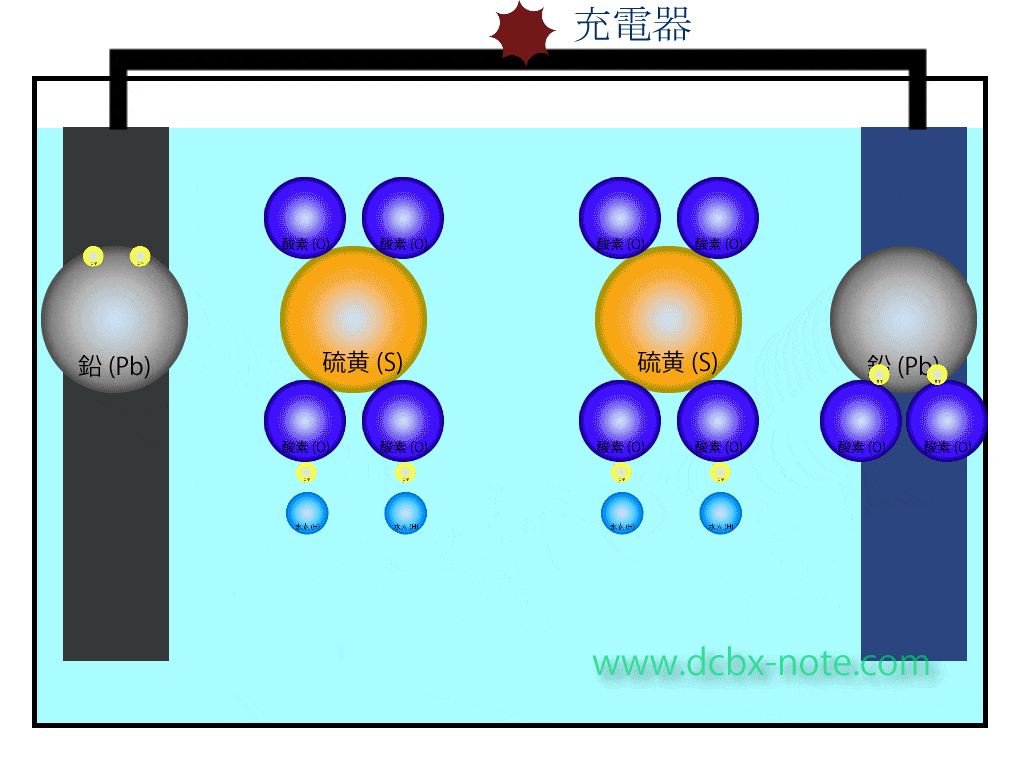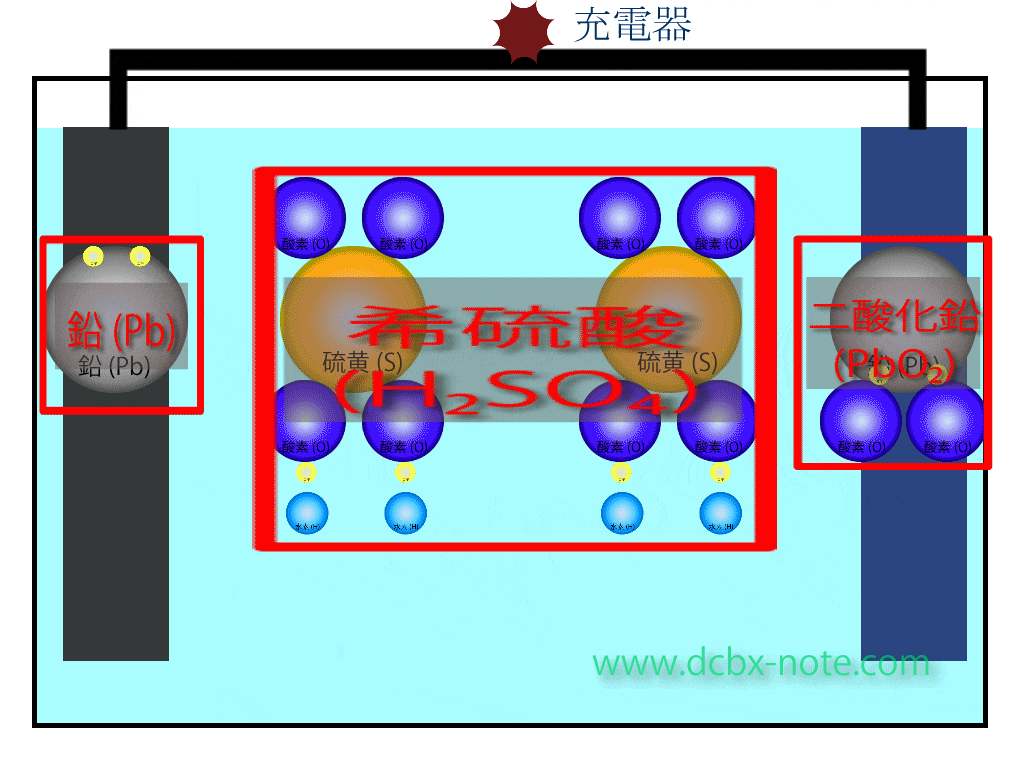
バッテリー内の化学反応(充電時)
陽極(プラス)側
硫酸鉛(PbSO4)の硫酸(SO4)と鉛(Pb)が分離します。
水(H2O)2個の水素4個と酸素2個が分離し、この酸素2個と鉛が結合して二酸化鉛(PbO2)になります。
このとき電子が放出され、回路を伝わって陽極(プラス)側から陰極(マイナス)側へ移動します。
余った水素は水素イオンの状態になっています。
陰極(マイナス)側
硫酸鉛(PbSO4)の硫酸(SO4)と鉛(Pb)が分離し、鉛原子は陽極から陰極に移動してきた電子を受け取り、金属の鉛(Pb)になります。
硫酸(SO4)はマイナスイオン状態で、陽極側で余ったプラスイオン状態の水素と結びつき、希硫酸になります。
まとめ
いかがでしたか?
鉛バッテリーの放電、充電のイメージをつかんでいただけましたか?
この鉛バッテリーの電圧は約2Vで、自動車用の鉛バッテリーは上記のしくみを6個直列にしてあり12Vの電圧があります。
ミニバイクなどは上記のしくみを3個直列にして6Vになっています。
厳密に言えば多少間違っているところがあるかもしれませんが、あくまでイメージですのでご容赦ください。
参考サイト
関連ページ


コメント